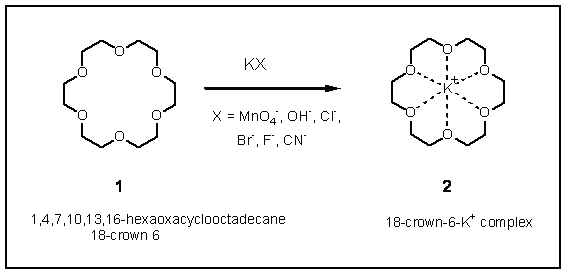
1960年代にPedersen (米国)は18-クラウン-6 (1) のような型の大環状ポリエーテルが陽イオンと安定な錯体を形成する能力が異常に強いことを発見した(この発見により後にノーベル化学賞を受賞).これは陽イオンがエーテルの酸素とうまく配位するためである.クラウンエーテル(ホスト)の穴に陽イオン(ゲスト)がうまく適合するほど,錯体は安定になる.この実験で合成するクラウンエーテルは18-クラウン-6(18員環,酸素原子6個)で,これの穴の直径は2.6から3.2?の間と推定されている.したがって,これは陽イオンの直径が夫々2.94, 2.86, 2.66 ?であるRb+, NH4+, K+と最も強く錯体をつくるが,Na+ (Na+の直径は2.2 ?)とはつくらない.陽イオンは穴の中に入り,陰イオンはこの陽イオンと会合するので,この錯体は有機溶媒に可溶となる.陰イオンは有機溶媒中では水溶液ほど強く溶媒和されず,したがってこの”裸”の陰イオン反応性が高い.例えば 1 はフッ化カリウムと錯体をつくり,ベンゼン溶媒中では反応性の高い求核試薬 (F-)となる.このフッ化カリウム錯体を使えば,第1級のフッ化アルキルが臭化アルキルから90%以上の収率で合成できる (SN2 反応).通常の条件(例えば,ジエチレングリコール中でのKF) では収率は40%程度である.水酸化カリウムとこのクラウンエーテルの錯体は有機溶媒中で塩化アリールの塩素を置換し,フェノールを生成する.これらの反応は多くの場合,ベンゼンのような非プロトン性溶媒中に固体無機化合物を溶解させるため,触媒量のクラウンエーテルが使われる.この場合,クラウンエーテルは固相と液相の相間移動触媒として作用することになる.1 はこの興味ある新系統の化合物中で最も簡単なものである.他のクラウンエーテルは大きさの違う陰イオンと錯体を形成する.非対称のクラウンエーテルがラセミ混合物の一方の光学対掌体と特異的に錯体をつくるような場合は,例えばアミノ酸の光学分割を容易にする.このようなホスト-ゲスト化学の研究は酵素と基質の間の錯体形成-錯体解離反応の研究に役立つ.クラウンエーテルは金属イオンと錯体を形成し,イオン輸送を行うという点で,大環状抗生物質と類似しており,そのため生化学者の興味を引いている.
この実験では,安価な溶媒であるトリエチレングリコール(3)と当モルの1,8-ジクロロ-3,6-ジオキサオクタン[1,2-ビス(2-クロロエトキシ)エタンともいう](4: 3の塩化チオニルによるクロロ化で容易に合成される)を水酸化カリウムの存在下に縮合し (Williamson エーテル合成法の一例) ,1を得る.クラウンエーテル,塩化チオニルによるクロロ化については,ともに「現代有機化学」上,9章で学習した.
この実習では,次のような操作をマスターする.
加熱溶融反応