本研究室の現在までの研究成果内容 -糖鎖科学を基盤とした感染症研究-
現在までの研究成果内容
ウイルス感染における糖鎖の生物機能の解明
○ウイルスの糖鎖結合研究
当研究室では、インフルエンザウイルス、パラインフルエンザウイルス、フラビウイルスが結合する糖鎖の構造について研究してきました。インフルエンザウイルスやパラインフルエンザウイルスは宿主細胞表面上に発現している糖鎖の末端の「シアル酸」に結合して、感染を開始します。シアル酸の分子種には、N-アセチル体(Neu5Ac)、N-グリコリル体(Neu5Gc)(図1)、4-O-アセチル(Neu4,5Ac2)、9-O-アセチル体(Neu5,9Ac2)などがあります。また、これらの糖鎖上でシアル酸はガラクトースと呼ばれる糖に結合しています。インフルエンザウイルスやパラインフルエンザウイルスが認識する「シアル酸とガラクトース(Gal)」の結合は主に二つ存在します。一つは、シアル酸の2位炭素とガラクトースの3位炭素がグリコシド結合した「シアル酸α2,3Gal」、もう一つはシアル酸の2位炭素とガラクトースの6位炭素がグリコシド結合した「シアル酸α2,6Gal」です(図2)。


・インフルエンザウイルスの受容体研究
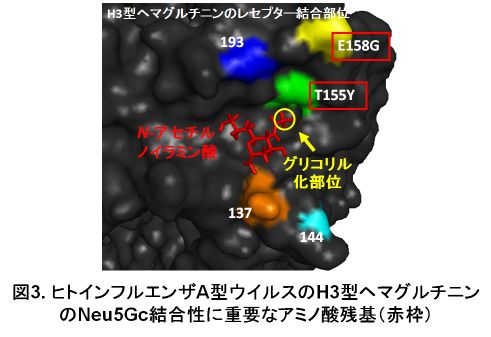
呼吸器の病原ウイルスであるインフルエンザウイルスは、ウイルス内部のタンパク質の抗原性によりA、B、C型に分類されています。A型は宿主域が広く、ヒト、ブタ、トリ、ウマなど多様な宿主が存在します。BおよびC型の宿主は、ヒト以外の動物への感染も報告さていますが、主にヒトが宿主となります。ヒトインフルエンザA型ウイルスは、ヒトの呼吸器に豊富に発現するNeu5Aα2,6Galへ強く結合します。トリインフルエンザA型ウイルスは、ニワトリの呼吸器に豊富に発現するNeu5Aα2,3Galへ強く結合します。ブタインフルエンザA型ウイルスは、ブタの呼吸器に発現するNeu5Aα2,6GalおよびNeu5Aα2,3Galの両方に結合します。また、ブタインフルエンザA型ウイルスはブタの呼吸にNeu5Acと同程度発現しているNeu5Gcα2,3Galとも結合します(図2)。ウマインフルエンザA型ウイルスは、ウマの呼吸器に豊富に発現するNeu5Gcα2,3Galに強く結合します。Neu5Gcは、ヒトのみが遺伝子的に活性のある合成酵素を持っていないため生合成できません。しかしながら、ヒトインフルエンザA型ウイルスの中にはNeu5Gcに結合できるものも見られます。ヒトのインフルエンザA型ウイルスのH3型ヘマグルチニンにおいて、Neu5Gcに結合できるか否かは、155番目または158番目のアミノ酸残基が重要であることを報告しています(図3)。一方、当研究室ではNeu5Gcを人為的に高発現させたヒト細胞でNeu5Gcの受容体機能を評価しており、Neu5Gcが従来言われていた受容体機能というよりもむしろ感染を抑制する受容体(デコイ受容体?)として機能することを報告しました。また、Neu5Gc研究の一つとして、Neu5Gcの合成に必須の酵素CMP-Neu5Ac hydoroxylase(CMAH)のバキュロウイウルス-タンパク質発現システムを使用した大量生産系を確立しました。ヒトCMAHは遺伝的欠損のため酵素活性がないことから、サルCMAH遺伝子を使用して酵素活性をもつCMAHを生産できるようになりました。さらに、CMAHがN型糖鎖をもつ糖タンパク質であることを世界で初めて報告しました。Neu5Gcの受容体機能は今後も検討していく必要があるものと考えています。インフルエンザA型ウイルスは異宿主間では基本的に伝播しない「宿主特異性」と呼ばれる性質があります。この受容体結合性の違いは、インフルエンザA型ウイルスが特定の宿主に感染できる宿主特異性に関わる因子の一つと考えられています。さらに、ヒトインフルエンザA型ウイルスはNeu5Aα2,6Galを有する長い糖鎖に結合性が強く、トリインフルエンザA型ウイルスはNeu5Aα2,3Galを有する短い糖鎖に結合性が強いことも分かっています。インフルエンザB型ウイルスはNeu5Acα2,6Galに、インフルエンザC型ウイルスはNeu5,9Ac2に強く結合します。過去にヒトでパンデミックを起こしたウイルス(1918年のスペインかぜ)や高病原性トリインフルエンザA型ウイルスのヒトへの感染に、ウイルスのNeu5Acα2,6Galに対する結合性の獲得が重要であることを示唆する報告もしています。
当研究室で行ってきた研究(共同研究)成果
Ito T, Suzuki T et al. Virology. 227, 493-499 (1997)
Masuda H, Suzuki T et al. FEBS Lett. 464, 71-74 (1999)
Suzuki Y et al. Virology. 189, 121-131 (1992)
Suzuki Y. Prog Lipid Res. 33, 429-457 (1994)
Takahashi T et al. FEBS Lett. 583, 3171-3174 (2009)
Takahashi T et al. J. Virol. 88, 8445-8456 (2014)
高橋忠伸: ウイルス感染における糖鎖の機能解明, Yakugaku-Zasshi 134 (8), 889-899 (2014)
Takahashi T and Suzuki T. Glycoscience: Biology and Medicine (Springer Publishing), 769-774 (2014)
Takahashi T et al. Biol. Pharm. Bull. 38, 1220-1226 (2015)
Takahashi T and Suzuki T. Sugar Chains (Springer Publishing), 71-93 (2015)
高橋忠伸: インフルエンザウイルスが結合する糖鎖分子の機能解明、日本ウイルス学会誌「ウイルス」第66巻1号, 101-116 (2016)
・パラインフルエンザウイルスの受容体研究
パラインフルエンザウイルスの糖鎖受容体に対する結合研究は、ヒト呼吸器の病原ウイルスであるヒトパラインフルエンザウイルス、げっ歯類の病原ウイルスであるセンダイウイルス、鳥類の病原ウイルスであるニューカッスル病ウイルスについて行ってきました。ヒトパラインフルエンザウイルスの血清型は1から4まであり、ヒトで主に流行するものは1型と3型です。ヒトパラインフルエンザウイルス1型は、Neu5Acα2,3Galに強く結合します。ヒトパラインフルエンザウイルス3型は、Neu5Acα2,3GalおよびNeu5Acα2,6Galの両方に強く結合します(図4)。ヒトパラインフルエンザウイルス3型は、ヒトが合成できないNeu5Gcα2,3Galへも結合します。3型の方が1型に比べ、肺炎に至りやすく、病原性が強いことが言われており、この病原性に糖鎖結合性の差が関係しているかもしれません。またこれらのウイルスは、血液型I(ラージアイ)抗原と呼ばれる分岐状ポリラクトサミン構造に特に強く結合することが分かっており、この糖鎖構造がヒトパラインフルウイルスの主要な受容体であるものと考えています。細胞上の糖鎖末端を人為的にNeu5Acα2,3GalとNeu5Acα2,6Galのどちらかに改変して、1型と3型の感染性を評価しました。細胞への感染に、1型はNeu5Acα2,3Galを、3型はNeu5Acα2,3GalとNeu5Acα2,6Galの両方を利用しており、各ウイルスの結合性と同様な結果が得られました。ヒトパラインフルエンザウイルス3型のNeu5Acα2,6Gal結合性を決めるウイルス側の変異部位(アミノ酸置換部位)を特定しました。さらに、センダイルイスおよびニューカッスル病ウイルスはNeu5Acα2,3Gal、Neu5Gcα2,3Galに結合することを報告しています。

当研究室で行ってきた研究(共同研究)成果
Suzuki Y, Suzuki T et al. J. Biochem. 93, 1621-1633 (1983)
Suzuki Y, Suzuki T et al. J. Biochem. 97, 1189-1199 (1985)
Suzuki T et al. J. Virol. 75, 4604-4613 (2001)
Fukushima K*, Takahashi T* (*they contributed equally as first authors) et al. Virology 464-465, 424-431 (2014)
Fukushima K*, Takahashi T* (*they contributed equally as first authors) et al. FEBS Lett. 589, 1278?1282 (2015)
・フラビウイルスの受容体研究
フラビウイルスの糖鎖受容体に対する結合研究は、ヒトにデング出血熱を引き起こすデングイルスについて行ってきました。デングウイルスが結合する糖鎖構造は世界的にいくつか報告されていますが、当研究室ではパラグロボシド(nLc4Cer)や硫酸化多糖の一種であるフコダイン、コンドロイチン硫酸Eを報告してきました。これらの糖鎖構造がデングイルスの受容体また宿主細胞への侵入過程に重要であるものと考えています。
当研究室で行ってきた研究(共同研究)成果
Aoki C, Hidari IPK et al. J. Biochem. 139, 607-614 (2006)
Hidari IPK et al. Biochem. Biophys. Res. Commun. 376, 91-95 (2008)
Kato D et al. Antiviral. Res. 88, 236-243 (2010)
Hidari IPK and Suzuki T. Antiviral. Expert Rev. Anti Infect. Ther. 9, 983-985 (2011)
Hidari IPK and Suzuki T. Antiviral. Tropical Medicine and Health, 39, S37-S43 (2011)
Wichit S et al. Microbiol. Immunol. 55, 135-140 (2011)
Chen et al. Biochem. Biophys. Res. Commun. 412, 136-142 (2011)
Hidari IPK et al. Biochem. Biophys. Res. Commun. 424, 573-578 (2012)
Hidari IPK et al. Viruses 5, 605-618 (2013)
Abe T et al. Biochem. Biophys. Res. Commun. 449, 32-37 (2014)
○インフルエンザA型ウイルスのシアリダーゼ活性の酸性安定性の分子機構の解明と、ウイルス増殖およびパンデミックとの関連性についての解析
インフルエンザA型ウイルスは、数十年に一度、8本の分節状のRNAゲノムが他の亜型や宿主などのインフルエンザA型ウイルスと置き換わることで、新型インフルエンザウイルスを発生し、ヒトにおいては世界規模の大流行「パンデミック」に至ることがあります。20世紀以降、1918年のH1N1型スペインかぜ、1957年のH2N2型アジアかぜ、1968年のH3N2型ホンコンかぜ、2009年のブタウイルス由来新型H1N1型ウイルスのパンデミックが知られています(文献によっては、1977年のH1N1型ソ連かぜがパンデミックに含まれていることがあります)。インフルエンザA型ウイルスの表面糖タンパク質「ノイラミニダーゼ」は、ウイルス受容体「シアル酸」を宿主細胞の糖鎖末端から切断する酵素活性「シアリダーゼ活性」を持っています。ウイルス株の中には、このシアリダーゼ活性が酸性条件下で安定に維持されるものと不可逆的に失活するものがあります。このようなシアリダーゼ活性の性状を「酸性安定性」と呼んでいます。本研究室では、インフルエンザA型ウイルスのシアリダーゼ活性の酸性安定性の分子機構の解明、ウイルス増殖およびパンデミックとの関連性について解析してきました。
・インフルエンザA型ウイルスのシアリダーゼ活性の酸性安定性の調査
現在流行しているヒトのインフルエンザA型ウイルスや過去の季節性のインフルエンザA型ウイルスの多くは、そのシアリダーゼ活性に「酸性安定性」の性状が見られません。一方、過去にパンデミックを起こしたヒトのウイルス株のシアリダーゼ活性には「酸性安定性」が見られます。2009年のパンデミックウイルスは発生初期の段階の2009年4月前半はこの酸性安定性が見られませんが、2009年4月後半には酸性安定性を獲得しています。ブタのインフルエンザA型ウイルスは、調べた株の中にはこの酸安定性が見られるものはありませんでした。また、高病原性H5N1型トリインフルエンザA型ウイルスを除く、トリのウイルスには、この酸性安定性が見られました。特にトリウイルスに見られる酸性安定性は、pH 4の酸性条件下で37℃、1時間処理してもシアリダーゼ活性が維持される「高い酸性安定性」を示しました。ヒトのパンデミックウイルスに見られる酸性安定性は、季節性のヒトウイルスに比べて高い酸性安定性を示しますが、酸性条件下において時間とともにそのシアリダーゼ活性は消失していきます。高病原性H5N1型トリインフルエンザA型ウイルスの多くの株のシアリダーゼ活性には、分離された宿主(ヒト、カモ、ニワトリなど)の違いは関係せず、一般的なトリインフルエンザA型ウイルスと異なり、酸性安定性は見られませんでした。なぜ高病原性H5N1型トリインフルエンザA型ウイルスのシアリダーゼ活性が他のトリウイルスと違うのか?については、まだ分かっていません。
当研究室で行ってきた研究(共同研究)成果
Takahashi T et al. J. Biochem. 130, 279-283 (2001)
Takahashi T, Suzuki T et al. FEBS Lett. 543, 71-75 (2003)
Suzuki T, Takahashi T et al. FEBS Lett. 557, 228-232 (2004)
鈴木 隆、高橋忠伸、鈴木康夫:パンデミックインフルエンザA型ウイルスノイラミニダーゼの構造と機能、遺伝子医学 糖鎖と病気、261-266 (2005)
高橋忠伸、鈴木康夫、鈴木 隆:インフルエンザウイルスとシアリダーゼ、生化学 78(日本生化学会), 409-413 (2006)
鈴木 隆、高橋忠伸、左 一八:インフルエンザウイルス感染におけるスパイク糖タンパク質とシアロ複合糖質の役割、実験医学増刊 波及・深化する糖鎖研究、30-36 (2007)
高橋忠伸、鈴木 隆:パンデミックインフルエンザウイルスの出現とノイラミニダーゼの酸性安定性、THE LUNG perspectives Vol. 17 No. 4, p. 83-88(株式会社メディカルレビュー社)(2009)
Takahashi T, Kurebayashi Y et al. PLoS One 5, e15556 (2010)
Takahashi T et al. FEBS Open Bio 2, 261-266 (2012)
Takahashi T et al. PLoS One 8, e64439 (2013)
・インフルエンザA型ウイルスのシアリダーゼ活性の酸性安定性を決めるノイラミニダーゼのアミノ酸残基の同定
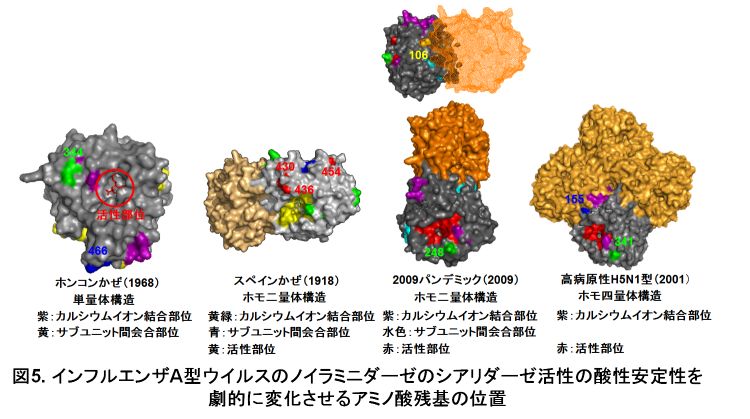
当研究室では、インフルエンザA型ウイルスのシアリダーゼ活性の酸性安定性を決めるノイラミニダーゼのアミノ酸残基を同定してきました。ノイラミニダーゼは、インフルエンザA型ウイルスの表面にある糖タンパク質でシアリダーゼ活性の酵素活性部位があり、ホモ四量体構造で(同じサブユニットタンパク質が四つ会合した構造)、現在までコウモリのインフルエンザA型ウイルスを含めるとN1~11までの亜型(抗原性)が知られています。アミノ酸残基を同定したノイラミニダーゼはN1型とN2型です。1968年のパンデミックホンコンかぜN2型はR344K、F466L、1918年のパンデミックスペインかぜN1型はQ430R、T435挿入、G454N、2009年のパンデミックN1型はI106V、D248N、2001年に分離された高病原性H5N1型トリN1型は、Y155H、N341Kと呼ばれるアミノ酸の変異(置換)によって、そのシアリダーゼ活性の酸性安定性を消失します(ここで表記されたアミノ酸番号は各ウイルス株のノイラミニダーゼのアミノ酸番号に対応しています)。これらのアミノ酸残基はいずれも、活性部位の近傍、カルシウムイオン結合部位の近傍、ホモ四量体構造のサブユニット間の会合部位(またはその近傍)に位置していました(図5)。カルシウムイオンは、ノイラミニダーゼのホモ四量体構造の安定化や酵素活性に重要な因子であると言われています。これらのアミノ酸残基の変化は、ノイラミニダーゼの酵素活性部位の構造やホモ四量体構造に影響を与え、シアリダーゼ活性の酸性安定性を劇的に変化させているものと考えています。
当研究室で行ってきた研究(共同研究)成果
Takahashi T, Suzuki T et al. FEBS Lett. 543, 71-75 (2003)
Suzuki T, Takahashi T et al. J. Virol. 79, 11705-11715 (2005)
鈴木 隆、高橋忠伸、鈴木康夫:パンデミックインフルエンザA型ウイルスノイラミニダーゼの構造と機能、遺伝子医学 糖鎖と病気、261-266 (2005)
高橋忠伸、鈴木康夫、鈴木 隆:インフルエンザウイルスとシアリダーゼ、生化学 78(日本生化学会), 409-413 (2006)
鈴木 隆、高橋忠伸、左 一八:インフルエンザウイルス感染におけるスパイク糖タンパク質とシアロ複合糖質の役割、実験医学増刊 波及・深化する糖鎖研究、30-36 (2007)
高橋忠伸、鈴木 隆:パンデミックインフルエンザウイルスの出現とノイラミニダーゼの酸性安定性、THE LUNG perspectives Vol. 17 No. 4, p. 83-88(株式会社メディカルレビュー社)(2009)
Takahashi T, Kurebayashi Y et al. PLoS One 5, e15556 (2010)
Takahashi T et al. FEBS Open Bio 2, 261-266 (2012)
Takahashi T et al. PLoS One 8, e64439 (2013)
・インフルエンザA型ウイルスのシアリダーゼ活性の酸性安定性はウイルス増殖を促進する
N1型やN2型のノイラミニダーゼにおいて、シアリダーゼ活性の酸性安定性を変化させるアミノ酸残基の変異を導入したウイルスの増殖性を比較した結果、シアリダーゼ活性の酸性安定性は培養細胞や動物(マウス)でウイルスの増殖性を促進することが分かりました。インフルエンザA型ウイルスは細胞に侵入する時に、酸性条件下に曝されるエンドサイトーシスと呼ばれる細胞の機構を利用します。シアリダーゼ活性の酸性安定性は、ウイルスが細胞に侵入する時にシアリダーゼ活性を維持するように働きます。おそらくこの機能がウイルス増殖を促進することに関係しているものと示唆されていますが、その詳細な機構は分かっていません。
当研究室で行ってきた研究(共同研究)成果
Suzuki T, Takahashi T et al. J. Virol. 79, 11705-11715 (2005)
高橋忠伸、鈴木康夫、鈴木 隆:インフルエンザウイルスとシアリダーゼ、生化学 78(日本生化学会), 409-413 (2006)
鈴木 隆、高橋忠伸、左 一八:インフルエンザウイルス感染におけるスパイク糖タンパク質とシアロ複合糖質の役割、実験医学増刊 波及・深化する糖鎖研究、30-36 (2007)
高橋忠伸、鈴木 隆:パンデミックインフルエンザウイルスの出現とノイラミニダーゼの酸性安定性、THE LUNG perspectives Vol. 17 No. 4, p. 83-88(株式会社メディカルレビュー社)(2009)
Takahashi T, Kurebayashi Y et al. PLoS One 5, e15556 (2010)
Takahashi T et al. PLoS One 8, e64439 (2013)
・インフルエンザA型ウイルスのシアリダーゼ活性の酸性安定性はパンデミックの発生を関わる?(季節性化に関わる?)
-1968年のパンデミックホンコンかぜ発生機構の解析-
当研究室では、過去の「パンデミック」ウイルスにシアリダーゼ活性の酸性安定性が見られることから、この酸性安定性とパンデミックとの関係について解析してきました。1968年に「ホンコンかぜ」と呼ばれるH3N2型ウイルスのパンデミックが発生しました。ホンコンかぜは、1957年に発生したパンデミック「アジアかぜ」に由来するヒトのH2N2型インフルエンザA型ウイルスのH2型ヘマグルチニン遺伝子が、トリインフルエンザA型ウイルスのH3型ヘマグルチニン遺伝子と置き換わったウイルスであると言われています。このウイルス遺伝子の置き換わり(交雑)は、ヒトウイルスとトリウイルスが感染するブタ(中間宿主)の中で起きたと言われています。当研究室では、1957年から1982年までのヒトインフルエンザA型ウイルスのN2型ノイラミニダーゼのシアリダーゼ活性の酸性安定性を調査しました。1957年と1968年のパンデミックウイルス以外の多くの季節性ウイルスのシアリダーゼ活性には酸性安定性が見られませんでした。しかし、1968年のホンコンかぜが発生する近辺の1967年から1968年のH2N2型ヒトウイルスには、「シアリダーゼ活性の酸性安定性を持っている」系統と「シアリダーゼ活性の酸性安定性を持っていない」系統が存在していたことが明らかになりました。N2型ノイラミニダーゼ遺伝子配列の分子系統解析を行うと、1968年のホンコンかぜのノイラミニダーゼ遺伝子は、1968年以前のH2N2型ヒトウイルスの中で「シアリダーゼ活性に酸性安定性を持っている」ノイラミニダーゼ遺伝子を受け継いでいたことが分かりました。しかし、1971年までのH3N2型ヒトウイルスの「シアリダーゼ活性に酸性安定性を持っていない」ノイラミニダーゼ遺伝子は、1968年のH2N2型ヒトウイルスの中で「シアリダーゼ活性に酸性安定性を持っていない」ノイラミニダーゼ遺伝子に置き換わり、現在までのH3N2型ヒトウイルス(Aホンコン型)として続いています。シアリダーゼ活性の酸性安定性はウイルス増殖を促進しますので、ヒトが今までに免疫されていない抗原型であった新型インフルエンザA型ウイルスのパンデミックの感染拡大に関わっていたかもしれません。パンデミック時の感染拡大が進行すると、パンデミックウイルスに対して免疫を獲得したヒト(宿主)が増えることになります。パンデミック後のウイルスが生き残っていくためには、ウイルスの増殖性を落とし、ある程度の遺伝子変異(抗原変異)を起こしながら、ある程度の宿主数を維持する必要があるかもしれません。これは数年ごとのウイルスの継続的な流行(季節性化)に相当するものと思われます。1968年のパンデミック後3年以内にホンコンかぜは、「シアリダーゼ活性の酸性安定性を持っていない」ノイラミニダーゼ遺伝子を獲得し、ウイルス増殖性を落としたことがウイルスの季節性化に関わっているかもしれません(図6)。当研究室がこれを報告した後(FEBS Lett. 557, 228-232, 2004)、米国CDCからも、1967年から1968年のH2N2型ヒトウイルスのノイラミニダーゼ遺伝子に二つの系統が存在していたこと、一方の系統がホンコンかぜに受け継がれ、もう一方の系統はホンコンかぜ以降のH3N2型ヒトウイルスに受け継がれたことが報告されています(Virology 328, 101-119, 2004)。

-2009年のパンデミック発生機構の解析-
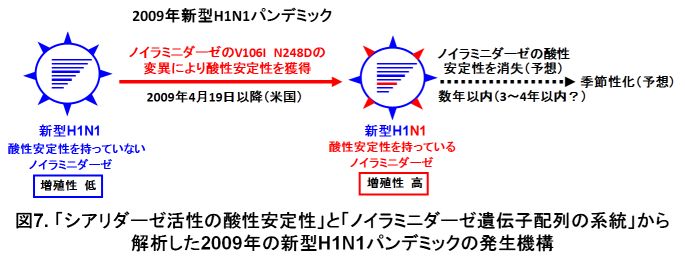
2009年の新型H1N1のパンデミックにおいて、シアリダーゼ活性の酸性安定性を調査しました。米国で分離された新型H1N1株で、2009年4月中旬(4月19日頃)以前は「シアリダーゼ活性の酸性安定性を持っていない」株で、それ以降は「シアリダーゼ活性の酸性安定性を持っている」株が出現して流行の主流となっていきました。米国で2009年4月19日以降にノイラミニダーゼのV106IとN248Dと呼ばれるアミノ酸の変異(置換)が生じたことで、新型H1N1ウイルスはシアリダーゼ活性の酸性安定性を獲得していきました。また、新型H1N1ウイルスの遺伝子を持っているウイルスを遺伝子工学の手法によって作製し、このウイルスのノイラミニダーゼにV106IとN248Dのアミノ酸の変異のみを与えると、新型H1N1ウイルスの増殖性は大きく促進しました。米国の新型H1N1感染患者の発症日が、2009年4月19日以降に急激に増加したことも報告されています(N. Engl. J. Med. 360, 2605-2615, 2009)。2009年のパンデミック初期段階で、2009年4月前半(米国)では「シアリダーゼ活性の酸性安定性を持っていない」増殖性の低いウイルスでしたが、4月後半以降に「シアリダーゼ活性の酸性安定性を持っている」増殖性の高いウイルスが主流となっていき、「シアリダーゼ活性の酸性安定性」がパンデミックの促進に関わったものと考えています(図7)。1968年のパンデミックホンコンかぜを例に考えると、パンデミック後しばらくは、新型H1N1ウイルスに感染して免疫されたヒト(宿主)が多いことから流行がほとんど見られませんが、パンデミック後の数年以内(3~4年以内)に「シアリダーゼ活性の酸性安定性」が消失して季節性化することで、再び数年ごとの流行が発生するものと予想しています。
当研究室で行ってきた研究(共同研究)成果
Suzuki T, Takahashi T et al. FEBS Lett. 557, 228-232 (2004)
Suzuki T, Takahashi T et al. J. Virol. 79, 11705-11715 (2005)
高橋忠伸、鈴木康夫、鈴木 隆:インフルエンザウイルスとシアリダーゼ、生化学 78(日本生化学会), 409-413 (2006)
鈴木 隆、高橋忠伸、左 一八:インフルエンザウイルス感染におけるスパイク糖タンパク質とシアロ複合糖質の役割、実験医学増刊 波及・深化する糖鎖研究、30-36 (2007)
高橋忠伸、鈴木 隆:パンデミックインフルエンザウイルスの出現とノイラミニダーゼの酸性安定性、THE LUNG perspectives Vol. 17 No. 4, p. 83-88(株式会社メディカルレビュー社)(2009)
Takahashi T, Kurebayashi Y et al. PLoS One 5, e15556 (2010)
Takahashi T et al. PLoS One 8, e64439 (2013)
Takahashi T and Suzuki T. Biol. Pharm. Bull. 38, 817-826 (2015)
Takahashi T. Trends Glycosci. Glycotechnol. (TIGG) 27 (158), J49-J60 (2015)
Takahashi T. Trends Glycosci. Glycotechnol. (TIGG) 27 (158), E49-E60 (2015)
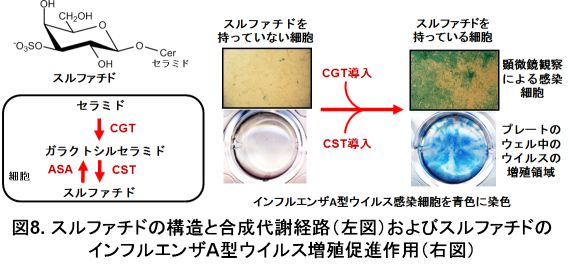
○硫酸化糖脂質スルファチドはインフルエンザA型ウイルスの増殖を促進する
インフルエンザA型ウイルスはシアル酸を持つ糖鎖に結合して、細胞へ感染していきます。しかし、当研究室ではインフルエンザA型ウイルスがシアル酸を持たない3-O-硫酸化ガラクトシルセラミド、一般的に「スルファチド」と呼ばれている糖脂質へも結合することを発見しました。スルファチドは、免疫、神経、血栓、がん、アポトーシス、などの疾患分野や、菌やエイズウイルスなどの感染症分野に関係する多くの生物活性を持つ糖脂質です。スルファチドの機能を解明することは、これらの多くの疾患機構の解明や治療法の開発において役立つことが期待されます。そこで当研究室では、スルファチドの機能をウイルス感染機構の研究から解析しています。
スルファチドの合成代謝は以下のことが知られています。セラミドからセラミド ガラクトシルトランスフェラーゼ(CGT)によりガラクトシルセラミドが合成されます。ガラクトシルセラミドにセレブロシド スルフォトランスフェラーゼ(CST)が作用することにより硫酸化されて、スルファチドが合成されます。また、アリールスルファターゼA(ASA)は、スルファチドの硫酸基を切断することでガラクトシルセラミドを合成します。これらのスルファチドの合成代謝に関係する酵素の遺伝子を、遺伝子工学の技術により制御することで、培養細胞のスルファチド合成を促進したり、抑制したりしました。スルファチドが多い細胞では、インフルエンザA型ウイルスの増殖性が高く、また、スルファチドの少ない(無い)細胞では、インフルエンザA型ウイルスの増殖性は低くなりました(図8)。もう少し詳しく調べてみると、スルファチドが多い細胞では、ウイルス感染細胞の子供のウイルスの産生が多くなっていました。また、スルファチドはシアル酸と違い、感染時の受容体としての機能は見られませんでした。
・スルファチドはインフルエンザA型ウイルスの表面にあるヘマグルチニンと結合する
インフルエンザA型ウイルスはシアル酸に結合して、細胞へ感染します。シアル酸はウイルスと細胞を結合する分子であり、受容体と呼ばれています。シアル酸は、インフルエンザA型ウイルスの表面にある「ヘマグルチニン」と呼ばれる、インフルエンザワクチンとしても使用されるタンパク質分子と結合します。それでは、スルファチドはウイルスのどこに結合しているでしょうか?当研究室では、インフルエンザA型ウイルスの表面にある「ヘマグルチニン」や「ノイラミニダーゼ」、ウイルスの中のタンパク質「核タンパク質」に結合するモノクローナル抗体を作製してきました。これらの抗体の中で、一部のヘマグルチニンに結合する抗体が、ウイルスとスルファチドの結合を阻害しました。さらに、昆虫ウイルス「バキュロウイルス」にインフルエンザA型ウイルスのヘマグルチニン遺伝子を組み込んで、このウイルスを感染させた昆虫細胞から、大量のヘマグルチニンを生産しました。ヘマグルチニンは通常、ウイルスを囲む膜に埋め込まれています。「バキュロウイルス」を用いて生産したヘマグルチニンは、ヘマグルチニンの膜に埋め込まれている部位を遺伝子的に取り去って、ウイルスの外側(細胞の外側)に突き出ている部分のみとなります。このヘマグルチニンは、ウイルス受容体のシアル酸に結合するとともに、スルファチドへも結合しました。このことから、インフルエンザA型ウイルスのヘマグルチニンの外に突き出た部分(細胞外ドメインまたはエクトドメインと呼ばれています)がスルファチドと結合することが分かりました。
ヘマグルチニンとスルファチドの結合の強さ(結合する速さと離れる速さ、結合速度定数と解離速度定数と呼ばれています)を測定しました。ヘマグルチニンとスルファチドの結合の強さは、ウイルス受容体のシアル酸(シアル酸を持っているガングリオシドGD1aと呼ばれている糖脂質)と比べて約2.6倍弱いものでした。離れる速さは、スルファチドとシアル酸の間でほぼ同程度でした。一方、結合する速さは、シアル酸の方が約2.6倍高いことが分かりました。ウイルスが細胞へ結合するときに、細胞の表面にはシアル酸を持っている糖鎖とスルファチドが存在していますが、受容体としては機能しないスルファチドよりも優先的にシアル酸へ結合できることで、細胞への感染を有利にしているものと思われます。
・スルファチドがどうやってインフルエンザA型ウイルスの増殖性を促進しているのでしょうか?
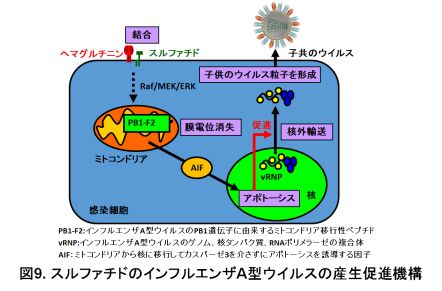
ヘマグルチニンはインフルエンザA型ウイルスの表面にあるだけでなく、ウイルス感染細胞内で合成されて、その細胞表面にも存在します。当研究室では、ヘマグルチニンとスルファチドの結合を阻害する抗体が、ウイルス増殖を阻害することから、おそらく感染細胞表面の「ヘマグルチニンとスルファチドの結合」がウイルスの増殖(産生)に重要であることが分かってきました。また、スルファチドがウイルス感染細胞の自殺(アポトーシスと呼ばれています)を促進することが分かってきました。このアポトーシスは、感染細胞表面の「ヘマグルチニンとスルファチドの結合」により開始されます。アポトーシスのシグナルは、ウイルス遺伝子から合成されたPB1-F2と呼ばれる分子が集まっているミトコンドリアと呼ばれる細胞内の器官を通過していきます。感染細胞内の核と呼ばれる器官には、ウイルス遺伝子とウイルスのRNAポリメラーゼ、核タンパク質の複合体(vRNPと呼ばれています)が集まっています。このvRNPは、子供のウイルスの中身であり、子供のウイルスを生産する上で重要な構成部品です。アポトーシスは、核に集まっているvRNPを核の外(細胞質)へ追い出します。核の外に追い出されたvRNPは子供のウイルスの構成部品として、子供のウイルス粒子の形成に使われます。これにより、感染細胞の子供のウイルスの生産が促進されます(もう少し詳細な機構は図9)。
当研究室で行ってきた研究(共同研究)成果
Suzuki T et al. Biochem. J. 318, 389-393 (1996)
Takahashi T et al. J. Virol. 82, 5940-5950 (2008)
Takahashi T and Suzuki T. The Open Dermatology Journal 3, 178-194 (2009)
Takahashi T and Suzuki T. Biochem. Res. Int. 2011, Article ID 245090, 23 pages (2011)
Takahashi T et al. J. Biochem. 147, 459-462 (2010)
高橋忠伸、鈴木 隆:スルファチドによるインフルエンザA型ウイルス増殖の促進Glycoforum, SEIKAGAKU CORPORATION (2010)
Takahashi T and Suzuki T. Biochem. Res. Int. 2011, Article ID 245090, 23 pages (2011)
Takahashi T et al. J. Biochem. 152, 373-380 (2012)
Takahashi T and Suzuki T. J. Lipid. Res. 53, 1437-1450 (2012)
Takahashi T et al. Glycoconj. J. 30, 709-716 (2013)
Takahashi T et al. PLoS One 8, e61092 (2013)
Takahashi T and Suzuki T. Biol. Pharm. Bull. 38, 809-816 (2015)
・スルファチドはヒトパラインフルエンザウイルス3型の膜融合活性を抑制する
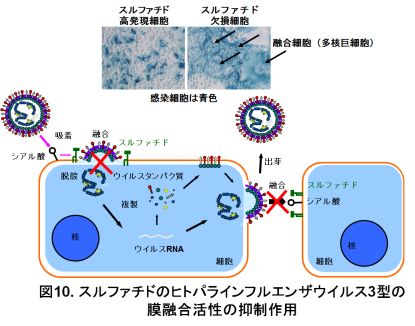
ヒトパラインフルエンザウイルスは、膜融合活性を示すフュージョンタンパク質を持っている。ウイルスが細胞表面に結合すると、この膜融合活性によりウイルス膜と細胞膜が融合し、ウイルス内部タンパク質やウイルス遺伝子が細胞内へと侵入する。また、感染細胞内部で合成されたフュージョンタンパク質は細胞表面へ運ばれる。このとき、隣接する細胞と膜融合を起こしていき、多くの核を持った巨大な細胞(多核巨細胞)を形成する。実際に多核巨細胞の形成には、フュージョンタンパク質とともに、ヘマグルチニン-ノイラミニダーゼタンパク質のシアル酸結合も必要です。
当研究室では、ヒトパラインフルエンザウイルス3型がスルファチドへ結合することを世界で初めて報告しました。ヒトパラインフルエンザウイルス3型をスルファチド欠損細胞に感染させると、1~2日後には多核巨細胞を形成します。しかし、スルファチド合成酵素遺伝子を導入したスルファチド高発現細胞に感染させると、多核巨細胞の形成は見られません(図10)。ウイルス感染性は、スルファチド高発現細胞で抑制されています。スルファチドはおそらく、ヒトパラインフルエンザウイルス3型の膜融合活性に関係する「感染初期の細胞表面におけるウイルス膜と細胞膜の融合(感染性)」と「感染後期の感染細胞膜と周囲の細胞膜の融合(多核巨細胞形成)」の過程で、膜融合を抑制しているものと思われます(図10)。当研究室では、ヒトパラインフルエンザウイルスの感染細胞が形成する多核巨細胞にアポトーシスが誘導されることを報告しています。ヒトパラインフルエンザウイルスの病毒性は多核巨細胞の形成と関連していることが考えられます。スルファチドは、ヒトパラインフルエンザウイルス3型の感染防御(感染性の抑制)や病毒性の制御(多核巨細胞の形成抑制)に働いているかもしれません。
当研究室で行ってきた研究(共同研究)成果
Takaguchi M, Takahashi T et al. J. Biochem. 149, 191-202 (2011)
Takahashi T et al. J. Biochem. 152, 373-380 (2012)
○抗ウイルス活性を示す物質の探索
・ヒトパラインフルエンザウイルスの創薬研究
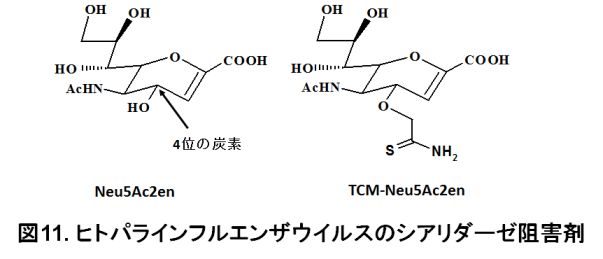
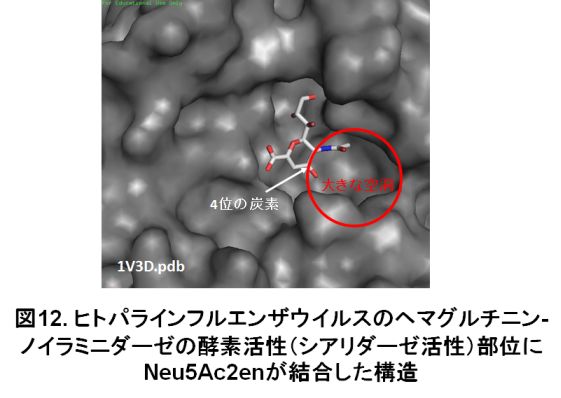
ヒトパラインフルエンザウイルスは乳幼児の主な呼吸器感染症ウイルスで、重症化すると肺炎を引き起こします。また、免疫不全患者に対しても脅威となります。日本のような少子化の国では特に重要なウイルス疾患と思われますが、特異的な治療薬やワクチンなどはまだ開発されていません。当研究室では、このヒトパラインフルエンザウイルスに対する治療薬開発に向けて、ウイルスに阻害作用を示す化合物を探索しています。ヒトパラインフルエンザウイルスは、「シアリダーゼ」と呼ばれる酵素活性を持っています。この活性を阻害すると、ウイルスの増殖を抑えることができます。現在、このシアリダーゼに対して阻害作用を示す化合物を探索しています。当研究室の研究成果により、一般的なシアリダーゼ阻害剤「2-deoxy-2,3-didehydro-N-acetylneuraminic acid (Neu5Ac2en)」の4位の炭素に結合する構造が、ヒトパラインフルエンザウイルスのシアリダーゼの阻害に重要であることが分かってきました。当研究室で開発した化合物で、Neu5Ac2enの4位の炭素にチオカルバモイル基が結合した構造「4-O-thiocarbamoylmethyl-2-deoxy-2, 3-didehydro-N-acetylneuraminic acid (TCM- Neu5Ac2en)」になっています(図11)。ヒトパラインフルエンザウイルスのシアリダーゼ活性を示すタンパク質「ヘマグルチニン-ノイラミニダーゼ」の表面には、酵素活性の部位であるポケットが存在します。Neu5Ac2enがこのポケットに結合したとき、Neu5Ac2enの4位の炭素に結合した水酸基の方向には大きな空洞があります(図12)。TCM-Neu5Ac2enの4位の炭素に結合したチオカルバモイル基は、この大きな空洞を埋めるために、ポケットへの結合力が強くなり、シアリダーゼの阻害作用も強くなるものと考えられます。TCM-Neu5Ac2enは、ヒトパラインフルエンザウイルスの増殖を阻害できることも明らかにしています。
当研究室で行ってきた研究(共同研究)成果
Suzuki T et al. Glycoconj. J. 18, 331-337 (2001)
鈴木 隆、鈴木康夫:パラインフルエンザウイルスの選択的感染阻害薬の開発研究、医学のあゆみ 201(4), 259 (2002)
鈴木 隆、鈴木康夫:パラインフルエンザウイルス感染を阻害する新規シアル酸誘導体の開発、バイオサイエンスとインダストリー 60 (7), 450-453 (2002)
Ikeda K et al. Carbohydr. Res. 339, 1367-1372 (2004)
Ikeda K et al. Bioorg. Med. Chem. 14, 7893-7897 (2006)
鈴木 隆、鈴木康夫:抗インフルエンザウイルス薬の開発について、呼吸器科 10(1), 37-41 (2006)
Ikeda K et al. Bioorg. Med. Chem. 16, 6783-6788 (2008)
鈴木 隆:抗インフルエンザ薬について、実験 治療, 699, 48-54 (2010)
Takaguchi M, Takahashi T et al. J. Biochem. 149, 191-202 (2011)
Nishino R, Ikeda K et al. Bioorg. Med. Chem. 2011 19, 2418-2427 (2011)
Itoh Y et al. Glycoconj. J. 29, 231-237 (2012)
Nishino R et al. Chem. Pharm. Bull. 61, 69-74 (2013)
Oba M et al. Heterocycles 89, 89-81 (2014)
・食品成分(またはその誘導体)などの抗ウイルス活物質の探索
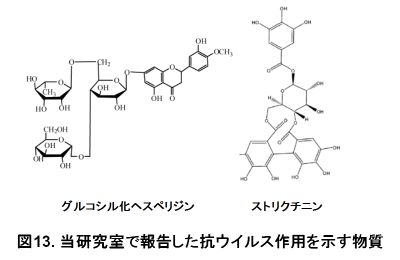
静岡が産地として有名な緑茶はかぜの予防に効果があることが知られています。かぜに代表されるインフルエンザウイルスに阻害効果を示す緑茶成分は、ポリフェノールの一種であるカテキンが広く知られています。当研究室では、カテキン以外の緑茶成分としてポリフェノールの一種である「ストリクチニン」が、インフルエンザウイルスやヒトパラインフルエンザウイルスに対して阻害効果を示すことを発見しています(図13)。インフルエンザウイルスが持っているヘマグルチニンは、シアル酸結合活性と膜融合活性を示します。ストリクチニンはヘマグルチニンに作用して、膜融合活性を阻害することで抗ウイルス活性を示します。
静岡が産地として有名なみかんの皮にはポリフェノールの一種である「ヘスぺリジン」と呼ばれる物質が含まれています。当研究室では、ヘスペリジンの水溶性を高めるために糖を付加したヘスペリジン(グルコシル化ヘスペリジン)が、インフルエンザウイルスに対して阻害効果を示すことを発見しています(図13)。グルコシル化ヘスペリジンは、インフルエンザウイルスのシアリダーゼ活性を阻害することで、ウイルスの増殖を阻害しています。
乳酸菌を継続摂取することで腸内環境が整えられて自然免疫が活性化することが知られています。乳酸菌の一種をマウスに継続経口摂取させると、インフルエンザウイルスに感染した際に、乳酸菌を摂取しなかったマウスに比べてひどい症状にならないことが分かりました。この要因の一つとして、乳酸菌を摂取したマウスには自然免疫の活性化がみられました。
また、本学免疫微生物学分野との共同で、インフルエンザウイルスの感染を阻害する抗体(IgG抗体)を粘膜膜免疫に重要な別のタイプの抗体(IgA抗体)に組み換えて、抗ウイルス活性の強い抗体を作製しました。
当研究室で行ってきた研究(共同研究)成果
Saha RK, Takahashi T et al. Biol. Pharm. Bull. 32, 1188-1192 (2009)
Saha RK, Takahashi T et al. Antiviral. Res., 88, 10-18 (2010)
鈴木 隆: 緑茶によるインフルエンザウイルスの予防効果、ファルマシア, 49,1080-1084 (2013)
鈴木 隆: インフルエンザ・かぜ予防. 新板茶の機能、新版 茶の機能(企画:日本茶業中央会)pp.151-159 (2013)
Kawahara T, Takahashi T et al. Microbiol. Immunol. 59, 1-12 (2015)
Shoji K, Takahashi T et al. Viral Immunol. 28, 170-178 (2015)
Tanaka T, Takahashi T, Suzuki T. Methods Mol. Biol. (Springer Publishing) 1367, 39-48 (2016)
○ウイルス分離・検出技術の開発
・高病原性H5型トリインフルエンザウイルスの受容体結合性の監視技術の開発
高病原性H5N1型トリインフルエンザウイルスは、ヒトに感染した場合、致死率6割に至る病原ウイルスです。現在のところ、ヒトの間での感染拡大は見られていません。しかしながら、一度ヒトの間で感染が広がると、飛行機などの輸送手段が発達した現在では、かなり速いスピードで世界中に感染が広がり、通常のインフルエンザウイルスと比べると病毒性の強いインフルエンザウイルスが世界規模の大流行(パンデミック)を起こすかもしれません。高病原性H5型トリインフルエンザウイルスのヒトの間の感染は、フェレットをモデル動物として実験されています。
本研究成果の最初の方をみていただければ説明が書いてありますが、インフルエンザウイルスが受容体として認識する「シアル酸(N-アセチルノイラミン酸、Neu5Acと省略します)とガラクトース(Gal)」の結合は主に二つ存在します。一つは、シアル酸の2位炭素とガラクトースの3位炭素がグリコシド結合した「Neu5Acα2,3Gal」、もう一つはシアル酸の2位炭素とガラクトースの6位炭素がグリコシド結合した「Neu5Acα2,6Gal」です。高病原性H5型トリインフルエンザウイルスの受容体結合性も、多くのトリインフルエンザウイルスと同様に「Neu5Acα2,3Gal」です。ヒトインフルエンザウイルスの受容体結合性は「Neu5Acα2,6Gal」です。つまり、高病原性H5型トリインフルエンザウイルスの受容体結合性が「Neu5Acα2,6Gal」になるように変異すると、ヒトに感染しやすくなることが予想されます。フェレットを用いたヒトの間の感染モデルでは、高病原性H5型トリインフルエンザウイルスの受容体結合性が「Neu5Acα2,3Gal」から「Neu5Acα2,6Gal」に変わることが、フェレットの間で感染が伝播する要因の一つであることが報告されています。この受容体結合性の変化を多くの検体からすぐに監視できる技術が必要であると考えています。
当研究室では、高病原性H5型トリインフルエンザウイルスの受容体結合性(「Neu5Acα2,3Gal」と「Neu5Acα2,6Gal」のどちらに結合するのか)を、トリの臨床検体である気管ぬぐい液や排泄腔ぬぐい液から直接、4時間以内の迅速さで測定する方法を開発しました。従来のインフルエンザウイルスの受容体結合性の測定法では、高濃度のウイルスが必要のため、臨床検体から孵化鶏卵や培養細胞を用いたウイルス培養やウイルスの回収、精製操作が必要となります。そのため、結果を得るまでに数日(当研究室でのプロトコールとタイムスケジュールでは一週間以上)を必要とします。新しい測定法では、ウイルス遺伝子を検出するのでウイルス遺伝子に対応したプライマー(短い遺伝子)を必要としますが、プライマーの合成は業者に委託した場合でも2-3日程度で行えます。一方、従来の測定法はウイルスに結合する抗体が必要です。抗体を作製するには、数週間はかかりますし、たとえ市販の抗体を購入できても、プライマー合成に比べたら費用がかなりかかります。また、インフルエンザウイルスは変異しやすいので、用意した抗体が結合しない場合も多々あると予想されます。従来の測定法で行うウイルス培養によって、受容体結合性が変化するウイルスの遺伝子変異のリスクも高くなります(図14)。
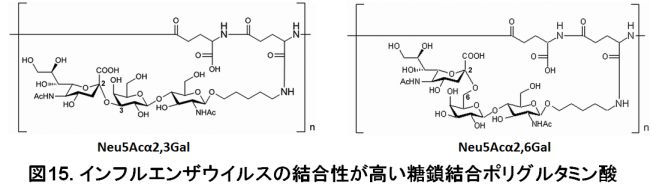
新しい測定法は、ウイルスを結合させる「Neu5Acα2,3Gal」と「Neu5Acα2,6Gal」の糖鎖にも当研究室の研究成果(静岡大学との共同研究)が使われています。「Neu5Acα2,3Gal」または「Neu5Acα2,6Gal」を持つ糖鎖を結合させたものは、納豆のネバネバの成分である「ポリグルタミン酸」です(図15)。糖鎖を持つこのような構造が、インフルエンザウイルスの糖鎖結合性を格段に高くすることを発見しました。ポリグルタミン酸に糖鎖を結合させることで、糖鎖が小さなかたまりを形成し(クラスター化と呼ばれています)、これによってウイルスの結合性が上昇するものと考えられています。当研究室や共同研究の多くの研究でこれらの糖鎖結合ポリグルタミン酸の使用実績があり、ヒトインフルエンザウイルス、高病原性H5N1型を含むトリインフルエンザウイルス、ブタインフルエンザウイルスの受容体結合性が従来法により測定されてきました。新しい測定法では、マイクロプレートに「Neu5Acα2,3Gal」または「Neu5Acα2,6Gal」の結合したポリグルタミン酸を吸着させ、ブロッキングと呼ばれる操作を行った後に、ウイルスを反応させます。ウイルスは「Neu5Acα2,3Gal」または「Neu5Acα2,6Gal」に良く結合しますので、結合したウイルス量をウイルス遺伝子の量で測定します。これにより、「Neu5Acα2,3Gal」や「Neu5Acα2,6Gal」にどのくらいの量のウイルスが結合したのか測定できます。
最近では、ウイルスの「Neu5Acα2,3Gal」や「Neu5Acα2,6Gal」の結合の見分ける糖鎖付加ポリマーを共同研究しています。

当研究室で行ってきた研究(共同研究)成果
Totani K et al. Glycobiology 13, 315-326, (2003)
Saito T et al. J. Med. Virol. 74, 336-343 (2004)
Yamada Y, Suzuki Y, Suzuki T et al. Nature 444, 378-382 (2006)
Oagata M et al. Bioorg. Med. Chem. 15, 1383-1393 (2007)
Hidari KIP et al. Glycobiology 18, 779-788 (2008)
Ogata M et al. Bioconj. Chem. 20, 538-549 (2009)
Ogata M et al. Biomacromolecules 10, 1894-1903 (2009)
Takahashi T et al. PLoS One 8, e78125 (2013)
Ogata M et al. J. Appl. Glycosci. 61, 1-7 (2014)
Tanaka T et al. ACS Macro Lett. 3, 1074-1078 (2014)
Tanaka T, Takahashi T, Suzuki T. Methods Mol. Biol. (Springer Publishing) 1367, 39-48 (2016)
・ヒトパラインフルエンザウイルス1型のプラーク形成法の確立と阻害剤耐性ウイルス株、プラーク形成変異株の分離
ウイルスの実験手法にプラーク形成法があります。ウイルスをかなり薄めて細胞に感染させます。ウイルス感染細胞に寒天培地をのせて、細胞を培養します(実際には、寒天培地を加えた細胞のプレートは逆さまにして培養します)。一個のウイルスが感染した細胞からウイルスが増殖し、周囲の細胞へと感染が拡大していきます。このとき、寒天培地なので細胞から放出されたウイルスが遠くの細胞に感染することはありません。一個の感染細胞から周囲の細胞へ感染が拡大していくと、感染細胞集団のかたまりとなります。多くのウイルスでは感染細胞は死にますので、丸い穴が開いたように感染細胞集団は脱落します。これをプラークと呼びます。プラークは、ウイルス感染の指標として使用されていますが、プラークをつついて新しい細胞で培養することによって、一個のウイルスから増殖したウイルス(ウイルスのクローンまたは株と呼んでいます)を分離できます。薬剤耐性ウイルス株や変異ウイルス株の分離にも多く使われる方法です。
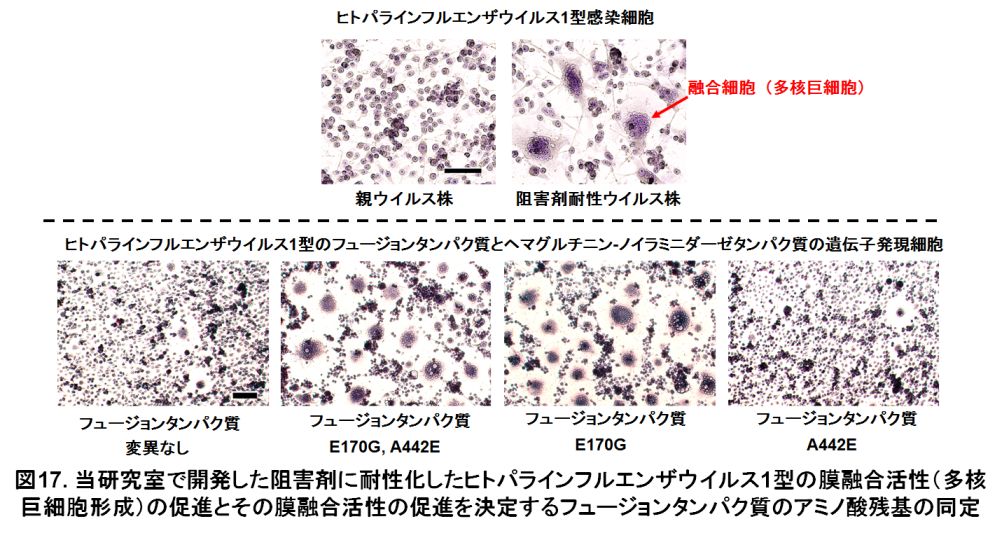
ヒトパラインフルエンザウイルス1型は細胞に感染しても、細胞が死ににくいことが知られています。プラーク形成法には不向きなウイルスでプラークができません。そのため、ウイルス感染の指標をプラークで測定することができず、ウイルス株の分離も困難です。当研究室では、ヒトパラインフルエンザウイルス1型のプラーク形成法を世界で初めて確立しました。プラーク形成のための、培養条件を検討し、寒天培地にニュートラルレッドと呼ばれる試薬を加えることでプラークを目で見えるようにしました。ニュートラルレッドは、生きている元気な細胞に取り込まれて色を染めます。ウイルス感染細胞で生きが悪い細胞または死んだ細胞は色が染まらないため、感染細胞集団(プラーク)が目で見えるようになります。これにより、ヒトパラインフルエンザウイルス1型のプラークが、感染後7日から10日で見ることができるようになりました(図16)。
ヒトパラインフルエンザウイルス1型のプラーク形成法を利用して、変異ウイルスを含むウイルス懸濁液の中から変異ウイルスを分離することができるようになりました。そこで、当研究室で開発したヒトパラインフルエンザウイルスの阻害剤「4-O-thiocarbamoylmethyl-2-deoxy-2, 3-didehydro-N-acetylneuraminic acid (TCM- Neu5Ac2en)」に対して耐性を示すヒトパラインフルエンザウイルス1型株を分離しました。この分離したウイルス株は高い膜融合活性(多核巨細胞の形成)を示しました。ウイルスの膜融合活性に関与するフュージョンタンパク質の遺伝子を解析したところ、E170GとA442Eと呼ばれる二つの変異がアミノ酸の変異(置換)が見られました。この二つの変異の中で、E170Gが膜融合活性を促進することが分かりました(図17)。また、この変異により形成される多核巨細胞は、細胞死(アポトーシスと呼ばれています)を起こすことが分かりました。阻害剤耐性ウイルス株は、親ウイルス株よりも高い増殖性を示し、おそらく膜融合活性の促進が感染性や子供のウイルス粒子を介さない感染(感染細胞が周囲の細胞へ膜融合すると、ウイルス遺伝子が他の細胞へも広がる)を増加させているものと考えています。また、ウイルスによる多核巨細胞の形成は細胞死につながるため、ウイルスの病毒性に関わっているかもしれません。TCM- Neu5Ac2enはヒトパラインフルエンザウイルスのシアリダーゼ活性に対する阻害剤ですが、耐性化においてシアリダーゼ活性の変化は見られませんでした。ヒトパラインフルエンザウイルスのシアリダーゼ阻害剤に対する耐性化の一つの機構として、膜融合活性の促進によるウイルス増殖性の増加があるものと思われます。
ヒトパラインフルエンザウイルス1型のプラーク形成法の開発過程で、通常はプラークを形成しない従来法でもプラークを形成するウイルス変異株が分離できました。このウイルス変異株の感染細胞は、周囲の細胞と融合して多核の巨細胞を形成しました。この現象を起こす要因の一つと考えられる、ウイルス表面のFタンパク質の変異を明らかにしました。Fタンパク質の131番目のアミノ酸が、イソロイシンからバリンへ変わっていました。この変異は、ウイルス増殖性の増加や一つの感染細胞から周囲の細胞への感染の広がりにもかかわっていました(図22)。細胞やウイルスの膜融合を担うFタンパク質の1変異が、感染細胞の形態やウイルス増殖性を変化させました。この変異が子ウイルス粒子を介さない感染(感染細胞が周囲の細胞へ膜融合すると、ウイルス遺伝子が他の細胞へも広がる)にもかかわっていると考えています。


当研究室で行ってきた研究(共同研究)成果
Fukushima K, Takahashi T et al. Biol. Pharm. Bull. 34, 996-1000 (2011)
Takaguchi M, Takahashi Tet al. J. Biochem. 149, 191-202 (2011)
Fukushima K, Takahashi Tet al. Biol. Pharm. Bull. 42, 827-832 (2019)
・ウイルス感染細胞を簡便・迅速に蛍光視覚化する技術の開発
インフルエンザA型、B型ウイルスは「シアリダーゼ」と呼ばれる酵素活性を持っています。この酵素活性は、ウイルスの表面でとげのように見えるノイラミニダーゼと呼ばれるタンパク質に由来しています。インフルエンザA型、B型ウイルスが細胞に感染すると、細胞内ではこのノイラミニダーゼがいっぱい作られます。感染して数時間すると(37℃で6~8時間ほど)、感染細胞の表面はノイラミニダーゼでいっぱいになります。つまり、感染細胞はかなり強い「シアリダーゼ」の酵素活性を持つことになります。
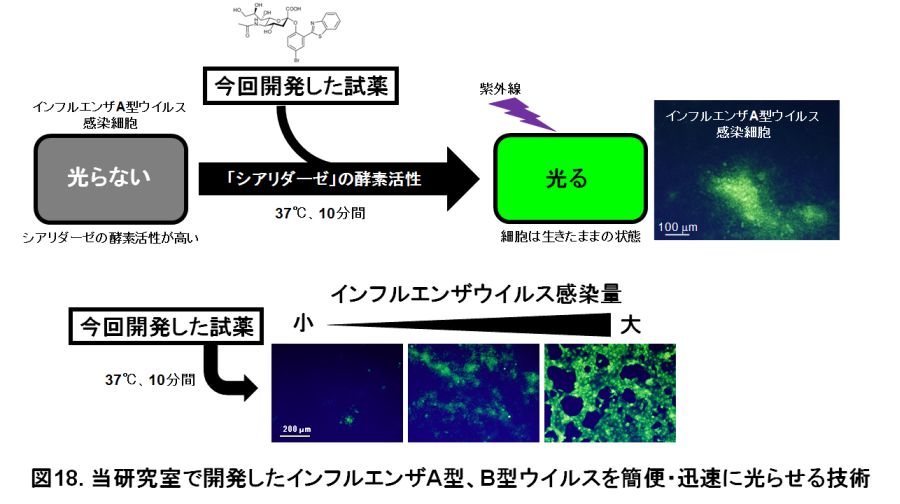
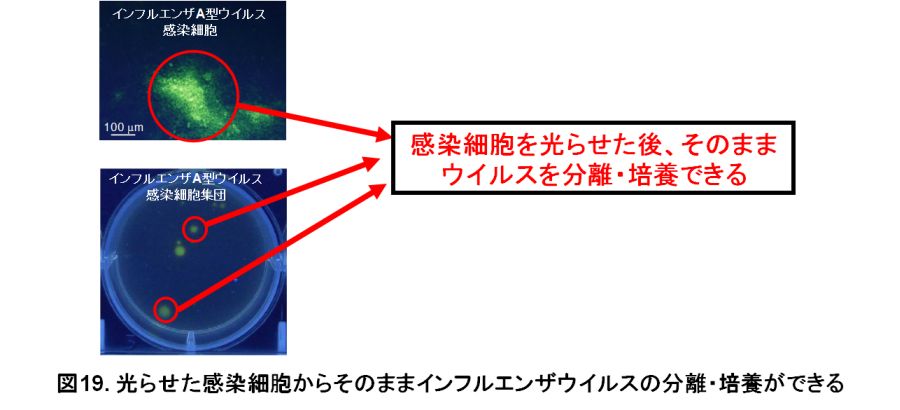
本研究室では広島国際大学薬学部などと共同で、この「シアリダーゼ」の酵素活性に反応して、その場所に光る物質(蛍光物質)が沈着する試薬「BTP3-Neu5Ac」を開発しました。つまり、「シアリダーゼ」の高い酵素活性を持つインフルエンザA型、B型ウイルス感染細胞に、今回開発した試薬を加えて、10分程度経ってから紫外線を当てると光らせることができます(図18)。今までは一般的に、ウイルス感染細胞を目で見えるようにするためには、一度細胞を殺して(固定化と言います)、ウイルスに反応する抗体を使用していました。しかし、ウイルスは変異が起こりやすく、抗体が反応しないこともあります。今回開発した技術は、ウイルスの抗体を必要とせず、さらに細胞を生きたままで感染細胞を光らせることができます。細胞を殺していないので、感染細胞を光らせた後はそのままウイルスの分離培養も行えます(図19)。
インフルエンザA型ウイルスには、ウイルス表面のとげとげの形状によりいくつかの亜型があります。例えば、Aホンコン型(H3N2型)やAソ連型(H1N1型)、高病原性鳥インフルエンザH5N1型などです。今回開発した試薬は、この亜型の違いに関わらず、過去に世界規模の大流行(パンデミック)を起こした新型(ヒトによっての新亜型)インフルエンザA型ウイルス、高病原性H5N1型鳥インフルエンザA型ウイルス、2013年に中国でヒトへの感染例が多く報告されたH7N9型鳥インフルエンザA型ウイルスの「シアリダーゼ」の酵素活性も光らせることができることを確認しました。シアリダーゼを持つ他のウイルス、5歳未満の小児ウイルス性肺炎の原因の2割りとも言われているヒトパラインフルエンザウイルス、げっ歯類病原ウイルスのセンダイルイス、鳥類病原ウイルスのニューキャッスル病ウイルスも光らせることを確認しました。ヒトパラインフルエンザウイルス1型は従来のプラーク形成法は適用が困難でした(この改良法は当研究室で報告したが、プラーク形成に7~9日間が必要)。しかし、今回開発した試薬で感染細胞(プラーク)を生きたまま光らせることでウイルスのプラーク(あるいは「フォーカス」とも呼ばれる)を3日間程度で確認でき、ヒトパラインフルエンザウイルス株の分離も簡便・迅速に可能となりました。また、この光らせるメカニズムを利用して、抗体に結合させた酵素「アルカリフォスファターゼ」も光らせることができます。 今回開発したインフルエンザA型、B型ウイルス感染細胞を光らせる技術は、極めて簡単な操作で(感染細胞を洗って試薬を加えるだけ)、10分程度の短時間で、ウイルスの抗体を必要とせず、生きた細胞のままで行うことができます。本技術は、ウイルスの学術研究や衛生検査の効率化に大いに貢献することが期待されます。さらに、小児呼吸器ウイルスのヒトパラインフルエンザウイルス、おたふく風邪ウイルス、鳥類病原ウイルスのニューキャッスル病ウイルス、マウス病原ウイルスのセンダイウイルスやこれらの感染細胞の簡単で短時間の検出にも応用できることが分かりました。
ウイルスなどの酵素を光らせる研究は、広島国際大学薬学部の池田潔教授と大坪忠宗准教授との共同研究です。
当研究室で行ってきた研究(共同研究)成果
Kurebayashi Y*, Takahashi T* (*they contributed equally as first authors) et al. Sci. Rep., 4, 4877 (2014)
Takano M*, Takahashi T* (*they contributed equally as first authors), Agarikuchi T, Kurebayashi Y et al. Virology 464-465, 206-212 (2014)
Takahashi T, Takano M, Agarikuchi T, Kurebayashi Y et al. J. Virol. Methods 209, 136-142 (2014)
Takahashi T et al. Biol. Pharm. Bull. 37, 1668-1673 (2014)
本論文は「Biol. Pharm. Bull. 37 (10), 2014」の表紙に選ばれました。
本論文は「Highlighted paper selected by Editor-in-Chief」に選ばれました。
Takahashi T*, Takano M* (*they contributed equally as first authors), Kurebayashi Y et al. Biol. Pharm. Bull. 38, 1214-1219 (2015)
Takahashi T, Agarikuchi T, Kurebayashi Y et al. PLoS One 10, e0144038 (2015)
高橋忠伸: ウイルス酵素を利用したウイルスや感染細胞の簡便、迅速な検出試薬の開発とその応用, 羊土社 実験医学(2015年8月号)Vol. 33. No. 13, p. 2114 (2015)
高橋忠伸: インフルエンザウイルスの新たな創薬や防疫戦略の開発をめざした研究, Aging & Health 73号(2015年4月発行、株式会社厚生科学研究所), 38-41 (2015)
Takahashi T. Trends in Glycoscience and Glycotechnology (TIGG) 27 (158), J49-J60 (2015)
Takahashi T. Trends in Glycoscience and Glycotechnology (TIGG) 27 (158), E49-E60 (2015)
大坪 忠宗、池田 潔、南 彰、高橋 忠伸、鈴木 隆: 蛍光組織染色が可能なシアリダーゼ蛍光プローブ, 和光純薬時報 Vol.84 No.2 (2016年4月発行), 5-7 (2016)
紅林佑希: 抗インフルエンザ薬耐性ウイルスの高感度検出分離法の開発、The Japanese Journal of Antibiotics, 69 (6), 357-366 (2016)
高橋忠伸: 一般財団法人 バイオインダストリー協会誌 B&I 74 (5)、p.463 (2016)
高橋忠伸、紅林佑希、大坪忠宗、池田 潔、南 彰、鈴木 隆: シアリダーゼを利用したウイルス感染細胞の蛍光イメージング、公益社団法人 日本分析化学会「分析化学」総説論文65 (12), 689-701 (2016)
・薬剤耐性インフルエンザウイルスを選択的に蛍光視覚化し分離する方法の確立
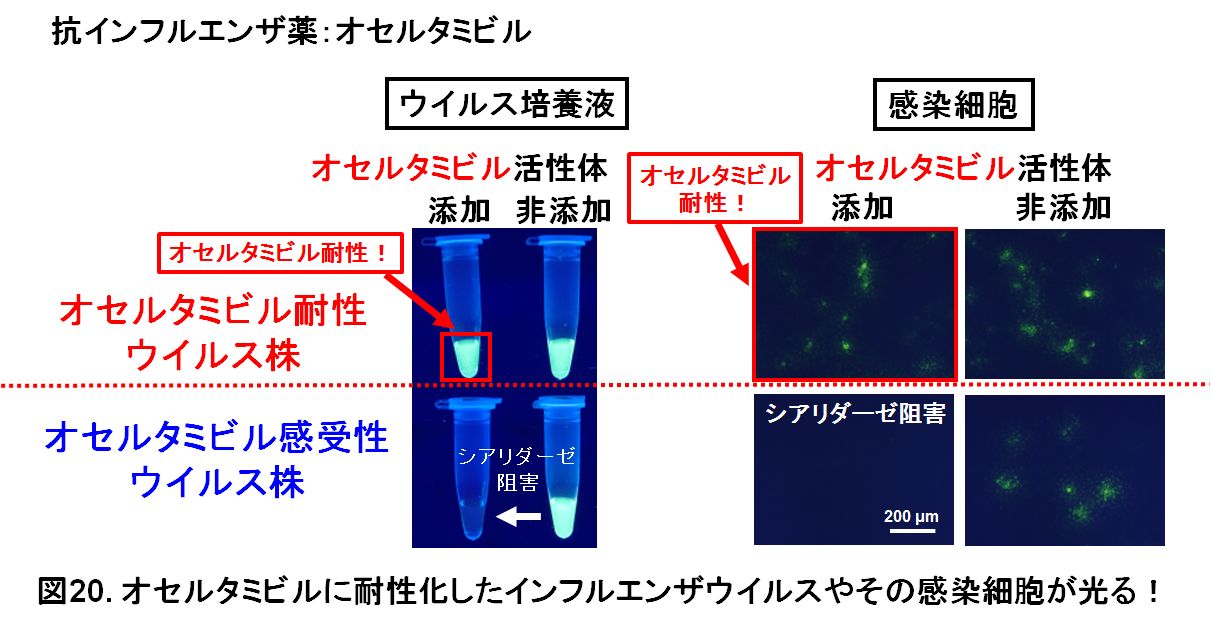
インフルエンザA型、B型ウイルスにはお薬があります。このお薬は、ノイラミニダーゼのシアリダーゼ活性を特異的に阻害します。そのため現在のインフルエンザのお薬は、「ノイラミニダーゼ(NA)阻害剤」「シアリダーゼ阻害剤」と呼ばれています。ウイルスはシアリダーゼ活性が阻害されると、感染細胞表面から出てきた子供のウイルスが細胞から離れることが出来なくなります。子供のウイルスが細胞から飛び散らないので、ウイルスの増殖は抑えられます。しかし、お薬を加えてもシアリダーゼ活性が阻害されない(阻害されにくい)ウイルスもあります。お薬の効かない(効きにくい)ウイルスを「薬剤耐性ウイルス」と呼びます。お薬が効く通常のウイルスは、「薬剤感受性ウイルス」と呼びます。タミフルの名前で知られるオセルタミビルというお薬に耐性化したインフルエンザA型ウイルスは、国内でも2008年頃に流行しました。
本研究室では、この「シアリダーゼ」の酵素活性に反応して、その場所に光る物質(蛍光物質)が沈着する試薬「BTP3-Neu5Ac」を開発しました。薬剤耐性インフルエンザウイルスやその感染細胞に、この試薬とお薬「抗インフルエンザ薬」を一緒に加えると、薬剤耐性のノイラミニダーゼのシアリダーゼ活性は阻害されませんのですぐに光らせることができます。しかし、通常の抗インフルエンザ薬に感受性のあるウイルスは、シアリダーゼ活性が阻害されますので光りません。細胞でウイルスを培養した液やウイルスの感染細胞に、シアリダーゼ活性を光らせる試薬とオセルタミビル(実験では実際にシアリダーゼ阻害効果を示す、オセルタミビルの活性体を使用します)を加えると、オセルタミビルに耐性化したインフルエンザA型ウイルスの培養液やその感染細胞を光らせることが出来ました(図20)。通常のオセルタミビルに感受性のあるインフルエンザA型ウイルスは光りません(図20)。このように、薬剤耐性インフルエンザウイルスやその感染細胞を選択的に光らせる方法を確立しました。
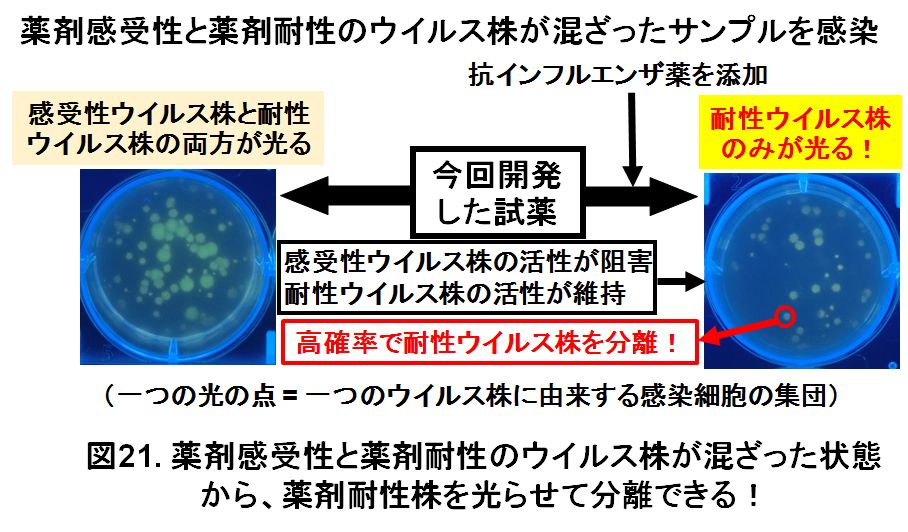
シアリダーゼ活性を光らせる試薬は、生きたままの感染細胞を光らせることが出来ます。この感染細胞を拾い上げることで、ウイルス株を分離することが出来ます。つまり、薬剤耐性インフルエンザウイルスの感染した細胞を選択的に光らせて、薬剤耐性ウイルス株を分離することが可能です。例えば、薬剤感受性のウイルス株と薬剤耐性のウイルス株が混ざった状態のサンプルがあり、この中から薬剤耐性ウイルス株のみを分離したいとします。このサンプルを感染させた細胞の中で、薬剤耐性ウイルスの感染細胞のみを光らせて、光った細胞からウイルス株を分離します。薬剤耐性ウイルス株を極めて高確率に分離することが出来ました(図21)。本研究室で確立した方法は、今後、薬剤耐性インフルエンザウイルスの調査や分離、薬剤耐性化メカニズムの解析などを効率化できるものと期待されます。
当研究室で行ってきた研究(共同研究)成果
Kurebayashi Y*, Takahashi T* (*they contributed equally as first authors) et al. PLoS One 11, e0156400 (2016)
紅林佑希: 抗インフルエンザ薬耐性ウイルスの高感度検出分離法の開発、The Japanese Journal of Antibiotics, 69 (6), 357-366 (2016)
高橋忠伸: 一般財団法人 バイオインダストリー協会誌 B&I 74 (5)、p.463 (2016)
高橋忠伸、紅林佑希、大坪忠宗、池田 潔、南 彰、鈴木 隆: シアリダーゼを利用したウイルス感染細胞の蛍光イメージング、公益社団法人 日本分析化学会「分析化学」総説論文65 (12), 689-701 (2016)
高橋忠伸、紅林佑希、大坪忠宗、池田 潔、南 彰、鈴木 隆:シアリダーゼを利用したウイルス感染細胞の蛍光イメージング、日本分析化学会「分析化学」総説論文65 (12), 689-701 (2016)
大坪忠宗、池田 潔、紅林佑希、南 彰、高橋忠伸、鈴木 隆:シアリダーゼ蛍光イメージング試薬の開発、BIO INDUSTRY(シーエムシー出版) Vol.33 (11), 70-79 (2016)
大坪忠宗、池田 潔、紅林佑希、南 彰、高橋忠伸、鈴木 隆:固体発光性色素を用いたシアリダーゼライブイメージングプローブの開発、有機合成化学協会誌 76 (12), 1272-1280 (2018)
高橋忠伸、紅林佑希、大坪忠宗、池田 潔、南 彰、鈴木 隆:薬剤耐性インフルエンザの蛍光検出単離法、BIO Clinica 33 (3) , 38-44 (2018)
Tadanobu Takahashi. Function of Molecular Species of Influenza Virus-Binding Sialic Acid and Development of a Sialidase-Based Technique for Detecting Virus. Trends Glycosci. Glycotechnol. 31 (181), SE80-SE82 (2019)
高橋忠伸:インフルエンザウイルスが結合するシアル酸分子種の機能解明とシアリダーゼを利用したウイルス検出技術の開発、Trends Glycosci. Glycotechnol. 31 (181), SJ80-SJ82 (2019)
Yuuki Kurebayashi, Tadanobu Takahashi, Tadamune Otsubo, Akira Minami, Kiyoshi Ikeda, Takashi Suzuki. Detection and Isolation of a Drug-Resistant Influenza Virus Using a Sialidase Fluorescence Imaging Technique. Trends Glycosci. Glycotechnol. In press (2019)
・薬剤耐性インフルエンザウイルスの高感度検出
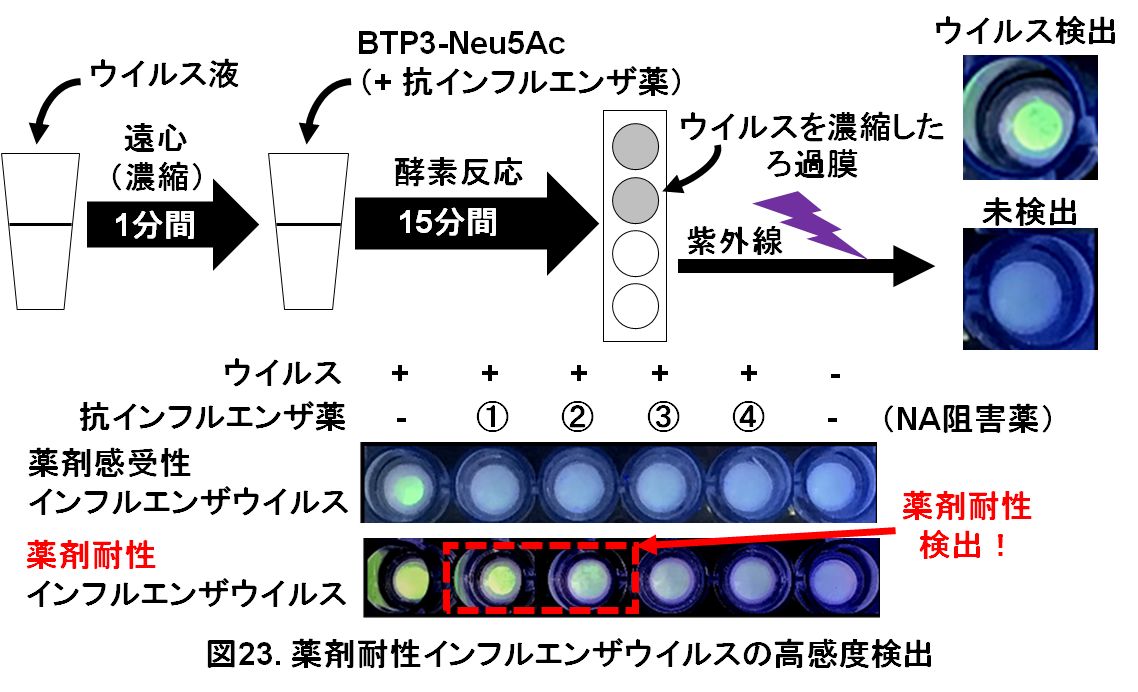
タンパク質の遠心濃縮マイクロチューブにインフルエンザウイルス液を添加して、遠心(1分間)によりタンパク質吸着膜へウイルスを濃縮しました。さらにウイルス酵素の蛍光剤BTP3-Neu5Acを添加して、最適化した酵素反応(15分間)を行いました。タンパク質吸着膜を取り外して紫外線を当てます。ウイルスが存在する場合、タンパク質吸着膜のウイルスが吸着した場所を高感度に光らせることができます。また、抗インフルエンザ薬[NA阻害薬、図23では①オセルタミビル(活性体)、②ぺラミビル、③ザナミビル、④ラニナミビル(活性体)]に耐性のウイルスを検出する場合、BTP3-Neu5Acと抗インフルエンザ薬の混合液を同時に反応させることで、各薬剤に対する耐性を光らせることができます(図23)。
当研究室で行ってきた研究(共同研究)成果
Daisuke Kato*, Yuuki Kurebayashi*, Tadanobu Takahashi* (*These authors contributed equally to this work), et al.. PLoS One 13, e0200761 (2018)
高橋忠伸、紅林佑希、加藤大介、大坪忠宗、池田 潔、南 彰、鈴木 隆:薬剤耐性インフルエンザの単離法と簡易高感度検出法、BIO Clinica 33 (9), 98-103 (2018)
高橋忠伸、紅林佑希、加藤大介、大坪忠宗、池田 潔、南 彰、鈴木 隆:薬剤耐性インフルエンザの蛍光イメージング法の開発、アグリバイオ 2 (13), 81-87 (2018)
大坪忠宗、池田 潔、紅林佑希、南 彰、高橋忠伸、鈴木 隆:固体発光性色素を用いたシアリダーゼライブイメージングプローブの開発、有機合成化学協会誌 76 (12), 1272-1280 (2018)
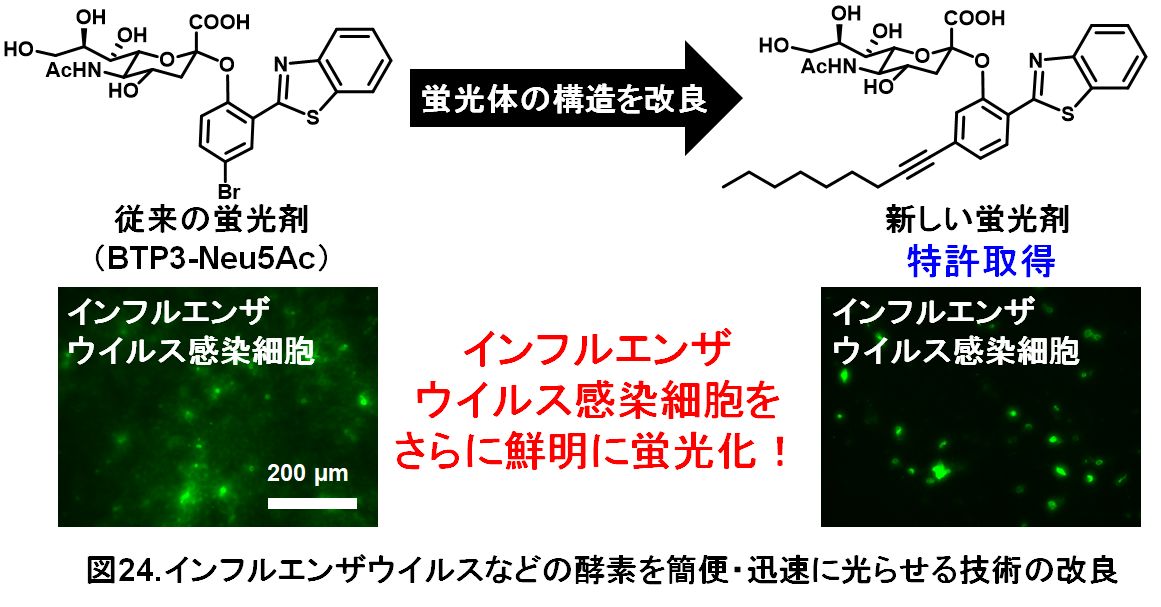
・インフルエンザウイルスなどの酵素を鮮明に光らせる新しい技術の開発
従来の蛍光剤BTP3-Neu5Acは、インフルエンザウイルス感染細胞を光らせたとき、光っている場所が少しずつ広がってしまい、光っている場所が正確にどのなのか?、鮮明さにやや欠けるところがありました。蛍光を発する構造を変えていくことで、光った場所が広がらずに鮮明のままになる新しい蛍光剤を開発しました。新しい蛍光剤を使用して、インフルエンザウイルス感染細胞を鮮明に光らせることができました(図24)。
当研究室で行ってきた研究(共同研究)成果
Yuuki Kurebayashi*, Tadanobu Takahashi* (* These authors contributed equally to this work), et al. ACS Chem. Biol. 14 (6), 1195-1204 (2019)
特許登録番号6493964、登録日2019年3月15日
